霍尔斯HOLVES发酵罐在大肠杆菌发酵中的精准温控与高效
时间:2025.04.11
在生物制药、食品添加剂和生物基材料生产中,大肠杆菌(Escherichia coli)因其快速增殖、遗传操作便捷和表达效率高等优势,成为工业化发酵的核心宿主之一。
一、大肠杆菌的特性及发酵环境要求
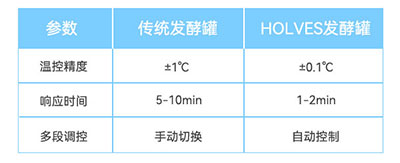
大肠杆菌是一种广泛应用于生物技术领域的原核微生物,具有生长迅速、遗传背景清晰、培养条件简单等优点。其代谢类型为兼性厌氧异养型,能够在有氧和无氧条件下生长。然而,大肠杆菌发酵过程面临着诸多挑战,尤其是在大规模生产中,传统发酵罐受限于控温精度低、参数调节滞后、补料策略单一等缺陷,难以满足高密度培养和工业化生产的稳定性需求。发酵环境的严苛要求主要体现在温度、溶氧、pH值等多个关键参数上。
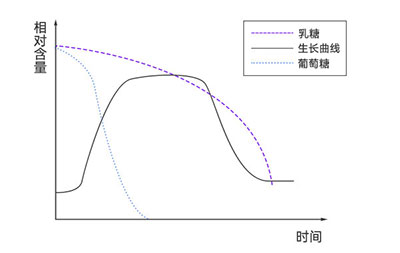
二、温度控制在大肠杆菌发酵中的重要性
温度是影响大肠杆菌生长和代谢的关键因素之一。大肠杆菌的最适生长温度通常为37℃,但在发酵过程中,温度的微小波动可能对其生长速率和产物合成产生显著影响。以工程大肠杆菌TY03菌株作为L-酪氨酸生产菌为例,通过单因素实验探究各变量对产量的影响时发现,当发酵温度处于35~36℃范围内,L-酪氨酸产量随温度升高而增加,并在36℃时达到最大值39.0 g/L。然而,当发酵温度超过36℃后,产量逐渐下降。分析其原因,可能是温度过高抑制了菌体的正常繁殖,导致L-酪氨酸代谢途径受阻,进而引起产量下降和菌体密度降低。因此,36℃被确定为最优发酵温度[1]。
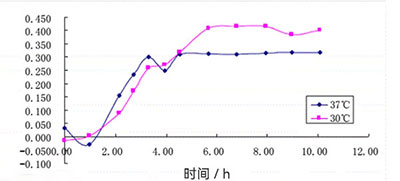
霍尔斯HOLVES发酵罐采用先进温控系统,精准维持温度稳定,为菌体生长和产物合成提供最佳条件。在常规的玻璃发酵罐上,配备24V低压安全电热毯和换热冷水管模块,结合HF-Control控制软件,实现加热和冷却过程的精确控制;不锈钢发酵罐则通过夹套恒温水加热配合换热冷水管控温。
分阶段温度调控可显著优化菌体生长与产物合成。例如,在诱导阶段,适当提高温度可以增强目标蛋白的表达,而在稳定期,降低温度有助于减少副产物的积累。利用这个特性进行过程分阶段温度控制策略:在诱导初期(13.5~20h),诱导温度采用40℃;21~37h降低温度至38℃;38h以后采用36℃,最终工程菌合成L-Phe的产量达到 52.7g/L,显著改善菌体生长和生产L-Phe的能力[2]。
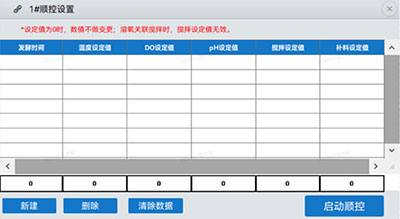
霍尔斯HOLVES发酵罐根据不同用户的发酵工艺需求,支持灵活设置不同时间段的温度参数,实现全程自动化控制。具体操作界面如下图一,除了温度,还可以设置溶氧、pH、搅拌转速和补料泵转速,这不仅节省了大量的人力和时间成本,还显著提高了发酵工艺的稳定性和效率。
霍尔斯HOLVES发酵罐根据不同用户的发酵工艺需求,支持灵活设置不同时间段的温度参数,实现全程自动化控制。具体操作界面如下图一,除了温度,还可以设置溶氧、pH、搅拌转速和补料泵转速,这不仅节省了大量的人力和时间成本,还显著提高了发酵工艺的稳定性和效率。
三、溶氧和pH对大肠杆菌生长的影响
除了温度控制,溶氧和pH值是影响大肠杆菌发酵的另外两个关键因素。大肠杆菌的生长和代谢活动高度依赖氧气供应,溶氧不足会导致菌体代谢受阻,进而影响产物合成。溶解氧的高低取决于通风量、搅拌转速、发酵罐的径高比、搅拌叶直径大小,以及培养液浓度、培养温度、罐压等因素[3]。
霍尔斯HOLVES发酵罐主要通过优化罐体的径高比,以及配置合适大小、类型的桨叶,同时HF-Control控制软件将溶氧值与搅拌速率、通气量关联,自动在范围内调节,确保发酵液中的溶氧浓度维持在适宜水平。
同时,pH值的严格控制也是大肠杆菌发酵成功的关键。例如在探究不同pH值对大肠杆菌发酵异亮氨酸的影响时,发现,前期控制发酵液pH保持7.2能够缩短前期菌体延滞期,中期pH 7. 0可降低最大比生长速率,减少乙酸生成,后期 pH 6.7能够有效降低NH4 +浓度,减缓菌体衰退,使菌体生物量及异亮氨酸产量得到有效提高。[4]
霍尔斯HOLVES发酵罐主要通过优化罐体的径高比,以及配置合适大小、类型的桨叶,同时HF-Control控制软件将溶氧值与搅拌速率、通气量关联,自动在范围内调节,确保发酵液中的溶氧浓度维持在适宜水平。
同时,pH值的严格控制也是大肠杆菌发酵成功的关键。例如在探究不同pH值对大肠杆菌发酵异亮氨酸的影响时,发现,前期控制发酵液pH保持7.2能够缩短前期菌体延滞期,中期pH 7. 0可降低最大比生长速率,减少乙酸生成,后期 pH 6.7能够有效降低NH4 +浓度,减缓菌体衰退,使菌体生物量及异亮氨酸产量得到有效提高。[4]
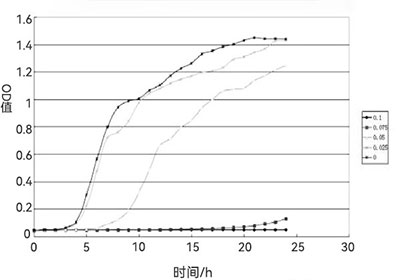
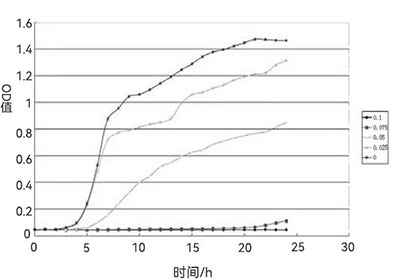
pH值过高或过低会直接影响菌体的生长和代谢产物的积累,霍尔斯HOLVES发酵罐配备的自动化控制系统能够实时监测pH值变化,并通过补酸或补碱操作维持发酵液的酸碱平衡。
通过精准控制溶氧和pH值,霍尔斯HOLVES发酵罐不仅优化了大肠杆菌的生长环境,还显著提高了发酵效率和产物质量。
通过精准控制溶氧和pH值,霍尔斯HOLVES发酵罐不仅优化了大肠杆菌的生长环境,还显著提高了发酵效率和产物质量。
四、发酵罐对大肠杆菌高密度培养的适配性与批次稳定性(补料)
大肠杆菌具有易培养、遗传学背景清楚、表达水平高、培养周期短等特点,成为目前应用最为广泛的基因工程合成异源蛋白的原核表达系统。而工业生产发酵是以最低的成本获得最高的细胞或其产物收益为基本目标,因此大规模高密度培养大肠杆菌的技术和工艺变得越来越重要。[5]
研究表明,高密度发酵受多种因素影响,如表达系统、培养基组成、发酵条件控制、补料策略等。[6] 除了以上介绍的高精度参数控制,霍尔斯还开发了多种补料方式用于不同的发酵场景。最基础是的恒速手动补料和周期性的按时补料,还有更适合高密度发酵的方程、指数补料,具体如下图二。其补料速率是与菌体生长速率呈方程或指数关系,可以维持营养物质浓度,并减少代谢副产物的积累。在重组大肠杆菌生产人生长激素的研究中,采用指数流加补料策略,菌体浓度达到120 OD525。[7]
研究表明,高密度发酵受多种因素影响,如表达系统、培养基组成、发酵条件控制、补料策略等。[6] 除了以上介绍的高精度参数控制,霍尔斯还开发了多种补料方式用于不同的发酵场景。最基础是的恒速手动补料和周期性的按时补料,还有更适合高密度发酵的方程、指数补料,具体如下图二。其补料速率是与菌体生长速率呈方程或指数关系,可以维持营养物质浓度,并减少代谢副产物的积累。在重组大肠杆菌生产人生长激素的研究中,采用指数流加补料策略,菌体浓度达到120 OD525。[7]
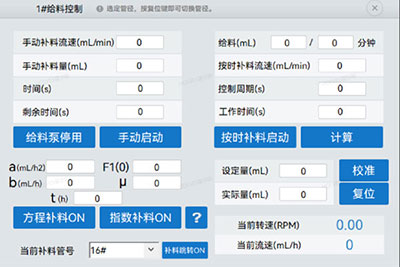
也可以根据发酵过程中的pH、溶氧实时参数进行动态调整补料速率,操作界面如下图三,更精确地控制发酵过程,避免营养物质过量或不足。例如发酵过程采用pH反馈控制补料策略,可以有效控制了乙酸的积累[8];采用溶氧反馈调节-限制性补料的方法,可以有效地降低有害物质的积累保持了工程菌的稳定性,提高目的蛋白的表达产量。[9] 多样化的操作模式使得霍尔斯HOLVES发酵罐具有高度适配性,显著提高大肠杆菌发酵的效率和产物产量。

大肠杆菌发酵的批次稳定性也是工业生产中的关键问题之一。霍尔斯HOLVES发酵罐除了要优化设计和精准控制参数,还确保罐体上所有的的硬件参数经过严格校准,减少设备间的差异。多联发酵罐系统(如Twin220和Hub240)支持平行发酵,对并联发酵罐的关键参数(如温度、pH、溶氧、搅拌速度、通气量等)进行同步控制和实时监测,确保不同批次发酵过程的一致性和可重复性。
霍尔斯HOLVES发酵罐凭借其精准的温度控制、高效的溶氧和pH调节能力,以及对大肠杆菌高密度培养的高度适配性,成功应对了大肠杆菌发酵过程中的严苛挑战。其在工业生产中的应用,不仅提高了发酵效率和产物产量,还确保了批次稳定性,为生物技术领域的大肠杆菌发酵提供了可靠的解决方案。
未来,随着AI算法和物联网(IoT)技术的深度融合,霍尔斯HOLVES将进一步优化预测性调控和远程监控能力,为合成生物学和绿色制造提供更智能的发酵平台。
参考文献:
[1]杜丽红,袁谨怡,战俊杰,等.大肠杆菌产L-酪氨酸发酵工艺优化[J].食品与发酵科技,2024,60(05):16-22.
[2]周海岩,刘龙,堵国成,等.诱导温度对大肠杆菌BR-42 ΔpykA(pAP-B03)发酵生产L-苯丙氨酸的影响[J].食品与发酵工业,2014,40(04):7-12.DOI:10.13995/j.cnki.11-1802/ts.2014.04.014.
[3]培养基内溶解氧的高低取决于哪些因素?[J].发酵科技通讯,2009,38(04):30.
[4]孙家凯,吴晓娇,史建明,等.pH值对大肠杆菌发酵异亮氨酸的影响[J].食品与发酵工业,2012,38(03):12-16.DOI:10.13995/j.cnki.11-1802/ts.2012.03.012.
[5]黎鸿平,黄海婵,钟卫鸿.大肠杆菌高密度培养研究进展[J].化学与生物工程,2012,29(08):1-5.
[6]冀成法,刘忠,马鲁南,等.重组大肠杆菌高密度、高表达研究进展[J].生物技术,2022,32(02):246-251.DOI:10.16519/j.cnki.1004-311x.2022.02.0040.
[7]李民,陈常庆. 重组大肠杆菌高密度发酵研究进展[J].生物工程进展,2000,Vol.20,No.2
[8]蒙健宗,陈发忠,王青艳,等.重组海藻糖合成酶工程菌的pH-stat高密度发酵工艺研究[J].食品工业科技,2006,(08):125-128.
[9]李毅,蒲勤,赵忠良,等.溶氧反馈-分批补料高密度培养人骨形成蛋白-2工程菌[J].生物工程学报,2002,(06):718-723.DOI:10.13345/j.cjb.2002.06.016.
霍尔斯HOLVES发酵罐凭借其精准的温度控制、高效的溶氧和pH调节能力,以及对大肠杆菌高密度培养的高度适配性,成功应对了大肠杆菌发酵过程中的严苛挑战。其在工业生产中的应用,不仅提高了发酵效率和产物产量,还确保了批次稳定性,为生物技术领域的大肠杆菌发酵提供了可靠的解决方案。
未来,随着AI算法和物联网(IoT)技术的深度融合,霍尔斯HOLVES将进一步优化预测性调控和远程监控能力,为合成生物学和绿色制造提供更智能的发酵平台。
参考文献:
[1]杜丽红,袁谨怡,战俊杰,等.大肠杆菌产L-酪氨酸发酵工艺优化[J].食品与发酵科技,2024,60(05):16-22.
[2]周海岩,刘龙,堵国成,等.诱导温度对大肠杆菌BR-42 ΔpykA(pAP-B03)发酵生产L-苯丙氨酸的影响[J].食品与发酵工业,2014,40(04):7-12.DOI:10.13995/j.cnki.11-1802/ts.2014.04.014.
[3]培养基内溶解氧的高低取决于哪些因素?[J].发酵科技通讯,2009,38(04):30.
[4]孙家凯,吴晓娇,史建明,等.pH值对大肠杆菌发酵异亮氨酸的影响[J].食品与发酵工业,2012,38(03):12-16.DOI:10.13995/j.cnki.11-1802/ts.2012.03.012.
[5]黎鸿平,黄海婵,钟卫鸿.大肠杆菌高密度培养研究进展[J].化学与生物工程,2012,29(08):1-5.
[6]冀成法,刘忠,马鲁南,等.重组大肠杆菌高密度、高表达研究进展[J].生物技术,2022,32(02):246-251.DOI:10.16519/j.cnki.1004-311x.2022.02.0040.
[7]李民,陈常庆. 重组大肠杆菌高密度发酵研究进展[J].生物工程进展,2000,Vol.20,No.2
[8]蒙健宗,陈发忠,王青艳,等.重组海藻糖合成酶工程菌的pH-stat高密度发酵工艺研究[J].食品工业科技,2006,(08):125-128.
[9]李毅,蒲勤,赵忠良,等.溶氧反馈-分批补料高密度培养人骨形成蛋白-2工程菌[J].生物工程学报,2002,(06):718-723.DOI:10.13345/j.cjb.2002.06.016.





